
معرفی اصول و روش های الایزا
ELISA test
آزمایش الایزا
یکی از مهم ترین روش های آزمایشگاهی تشخیص طبی استفاده از روش های الایزا است که در ادامه با تست الایزا (آزمایش Elisa) آشنا خواهید شد.
لطفاً، با تستا همراه باشید.
فهرست مطالب
تست الایزا چیست؟
ELISA test
سنجش ایمونوسوربنت مرتبط با آنزیم که ELISA یا EIA نیز نامیده میشود، آزمایشی است که آنتیبادیهای موجود در خون شما را شناسایی و اندازهگیری میکند. از تست الایزا (آزمایش Elisa) می توان برای تعیین اینکه آیا آنتی بادی های مرتبط با شرایط عفونی خاص دارید یا خیر، استفاده کرد. آنتی بادی ها پروتئین هایی هستند که بدن شما در پاسخ به مواد مضری به نام آنتی ژن تولید می کند.
این تکنیک شامل پیروی از سه اصل در ترکیب است که آن را به یکی از خاص ترین و حساس ترین روش های ایمنی نسبت به سایر روش های ایمنی برای تشخیص مولکول بیولوژیکی تبدیل می کند:
- یک واکنش ایمنی یعنی واکنش آنتی ژن-آنتی بادی.
- واکنش شیمیایی آنزیمی یعنی آنزیم تشکیل محصول رنگی (کروموژنیک) را از سوبسترا بی رنگ کاتالیز می کند.
- تشخیص و کمیت سیگنال یعنی تشخیص و اندازه گیری شدت رنگ محصولات رنگی تولید شده توسط آنزیم و سوبسترای اضافه شده.
تاریخچه تست الایزا (آزمایش Elisa)
قبل از توسعه ELISA، تنها گزینه برای انجام یک روش ایمونواسی، رادیو ایمونواسی بود، تکنیکی که از آنتی ژن ها یا آنتی بادی های نشاندار شده رادیواکتیو استفاده می کرد. در رادیوایمونواسی، رادیواکتیویته سیگنالی را ارائه می دهد که نشان می دهد آنتی ژن یا آنتی بادی خاص در نمونه وجود دارد یا خیر.
رادیوایمونواسی اولین بار در یک مقاله علمی توسط روزالین ساسمن یالو و سولومون برسون که در سال ۱۹۶۰ منتشر شد، توصیف شد. از آنجایی که رادیواکتیویته یک تهدید جدی برای سلامتی ایجاد می کند، جایگزین ایمن تری مورد جست و جو قرار گرفت. یک جایگزین مناسب برای سنجش رادیو ایمونواکتیو، یک سیگنال غیر رادیواکتیو را به جای سیگنال رادیواکتیو جایگزین می کند.
هنگامی که آنزیم ها (مانند پراکسیداز ترب کوهی= enzyme horseradish peroxidase “HRP”) با سوبستراهای مناسب (مانند ABTS یا TMB) واکنش می دهند، تغییر رنگ رخ می دهد که به عنوان یک سیگنال استفاده می شود. با این حال، سیگنال باید با حضور آنتی بادی یا آنتی ژن مرتبط باشد، به همین دلیل است که آنزیم باید به یک آنتی بادی مناسب مرتبط شود.
این فرآیند پیوند به طور مستقل توسط Stratis Avrameas و G. B. Pierce توسعه داده شد. از آنجایی که لازم است هر گونه آنتی بادی یا آنتی ژن غیر متصل را با شستشو از بین ببرید، آنتی بادی یا آنتی ژن باید روی سطح ظرف ثابت شود. یعنی ایمونوسوربنت باید تهیه شود. تکنیکی برای انجام این کار توسط واید و جرکر پورث در سال ۱۹۶۶ منتشر شد.
در سال ۱۹۷۱، پیتر پرلمان و اوا انگوال در دانشگاه استکهلم در سوئد، و آنتون شوورز و باوک ون ویمن در هلند به طور مستقل مقالاتی را منتشر کردند که این دانش را در روشهایی برای انجام EIA/ELISA ترکیب میکردند.
ELISA سنتی معمولا شامل گزارشگرها و بسترهای کروموژنیک است که نوعی تغییر رنگ قابل مشاهده برای نشان دادن وجود آنتی ژن یا آنالیت ایجاد می کند. تکنیکهای مشابه الایزا جدیدتر از گزارشگرهای PCR فلوروژنیک، الکترو کمی لومینسانس و کمی مخالف برای ایجاد سیگنالهای قابل اندازهگیری استفاده میکنند.
این گزارشگران جدید می توانند مزایای مختلفی از جمله حساسیت بالاتر و مالتی پلکسی داشته باشند. از نظر فنی، سنجشهای جدیدتر از این نوع بهطور دقیق ELISA نیستند، زیرا “مرتبط با آنزیم” نیستند، اما در عوض به برخی از گزارشگرهای غیر آنزیمی مرتبط هستند. با این حال، با توجه به اینکه اصول کلی در این سنجش تا حد زیادی مشابه است، آنها اغلب در همان دسته ELISA گروه بندی می شوند.
در سال ۲۰۱۲، یک تست الایزا (آزمایش Elisa) فوق حساس و مبتنی بر آنزیم با استفاده از نانوذرات به عنوان گزارشگر کروموژنیک توانست سیگنال رنگی با چشم غیرمسلح به واسطه تشخیص آتوگرام های صرف آنالیت بدهد. رنگ آبی برای نتایج مثبت و رنگ قرمز برای منفی ظاهر می شود.
توجه داشته باشید که این تشخیص تنها می تواند وجود یا عدم وجود آنالیت را تأیید کند، نه غلظت واقعی را.
تست الایزا (آزمایش Elisa) برای اولین بار توسط Eva Engvall و Peter Perlmann در سال ۱۹۷۱ توصیف شد. این سنجش به عنوان یک ابزار تشخیصی در پزشکی، آسیب شناسی گیاهی و بیوتکنولوژی و همچنین کنترل کیفیت در صنایع مختلف استفاده شده است.
علت نامگذاری(enzyme-linked immunosorbent assay) ELISA
ELISA به این دلیل نامگذاری شده است که روش تست الایزا شامل استفاده از یک سیستم آنزیمی و ایمونوسوربنت است. ELISA شامل آنتی بادی هایی است که به آنزیم ها متصل شده اند. آنزیمها قادر به کاتالیز کردن واکنش هستند و محصول نهایی قابل مشاهده را تولید میکنند. اصطلاح مرتبط با آنزیم به اتصال کووالانسی آنزیم به آنتی بادی اشاره دارد.
آزمایش Elisa در تشخیص کدام بیماری های کاربرد دارد؟
- HIV که باعث بروز بیماری ایدز می شود
- بیماری لایم
- کم خونی خطرناک
- تب کوههاى راکى
- روتاویروس
- سرطان سلول سنگفرشی
- سیفلیس
- توکسوپلاسموز
- ویروس واریسلا زوستر که باعث آبله مرغان و زونا می شود
- ویروس زیکا
آزمایش Elisa اغلب به عنوان یک ابزار غربالگری قبل از انجام آزمایش های بیشتر استفاده می شود. اگر علائم یا علائم شرایط فوق را دارید، پزشک ممکن است این آزمایش را درخواست کند. اگر پزشک بخواهد هر یک از این شرایط را رد کند، ممکن است تست الایزا (آزمایش Elisa) را نیز تجویز کند.
موارد استفاده از تست الایزا
تست الایزا کاربردهای گسترده ای در تمامی زمینه های میکروبیولوژی دارد. برای غربالگری یا تعیین کمیت آنتی ژن ها یا آنتی بادی ها در نمونه های بیمار استفاده می شود.
باکتری شناسی
تست مستقیم الایزا برای تشخیص آنتی ژن استرپتوکوک گروه A در سواب گلو، اگزوتوکسین های C. difficile در مدفوع و سم بوتولینوم در نمونه غذا استفاده می شود.
آزمایشهای تشخیص آنتیبادی برای تشخیص تب لکهای کوه راکی (ناشی از Rickettasia rickettsia) در دسترس هستند.
ویروس شناسی
تست مستقیم الایزا برای تشخیص آنتی ژن های ویروسی در نمونه های مختلف بیمار استفاده می شود. آزمایش Elisa معمولاً برای تشخیص آنتی ژن P24 ) تشخیص HIV، تشخیص هپاتیت B (HBsAg) تشخیص آنتی ژن ویروس آنفلوانزا و تشخیص آنتی ژن روتا ویروس استفاده می شود.
تست الایزا غیرمستقیم آنتی بادی های ویروسی خاص علیه ویروس هپاتیت C، ویروس Chikungunya، ویروس Zika، ویروس لنفوتروپیک سلول T انسانی و HIV را در سرم بیمار تشخیص می دهد.
قارچ شناسی
آزمایش تشخیص آنتی ژن برای تشخیص هیستوپلاسموز در دسترس است. این آزمایش وجود آنتی ژن هیستوپلاسما را در نمونه بافت بیمار تشخیص می دهد.
انگل شناسی
در انگل شناسی از ELISA مستقیم برای تشخیص آنتی ژن ژیاردیا و آنتی ژن اختصاصی پروتئین P. falciparum استفاده می شود. آزمایش Elisa غیرمستقیم برای تشخیص آنتی بادی های IgM علیه آنتی ژن Trypanosoma brucei برای تشخیص تریپانوزومیازیس آفریقاییو آنتی ژن علیه Taenia solium در دسترس است.
آزمایش Elisa چگونه انجام می شود؟
تست الایزا (آزمایش Elisa) شامل نمونه برداری از خون شما است. اول، بازوی شما را با یک ضد عفونی کننده تمیز می کند. سپس، یک تورنیکه یا نوار، در اطراف بازوی شما قرار میگیرد تا فشار ایجاد کند و باعث شود رگ های شما متورم شوند. در مرحله بعد، یک سوزن در یکی از رگهای شما قرار میگیرد تا نمونه کوچکی از خون گرفته شود.
هنگامی که خون کافی جمع آوری شد، سوزن برداشته می شود و یک باند کوچک روی بازوی شما در جایی که سوزن بود قرار می گیرد. از شما خواسته می شود که فشار را در محلی که سوزن در آن وارد شده است برای چند دقیقه حفظ کنید تا جریان خون کاهش یابد. این روش باید نسبتاً بدون درد باشد، اما بازوی شما ممکن است پس از انجام آن کمی ضربان داشته باشد.
نمونه خون برای تجزیه و تحلیل به آزمایشگاه ارسال می شود. در آزمایشگاه، یک تکنسین نمونه را به یک ظرف پتری حاوی آنتی ژن خاص مربوط به شرایطی که شما در حال آزمایش هستید اضافه می کند. اگر خون شما حاوی آنتی بادی برای آنتی ژن باشد، این دو به یکدیگر متصل می شوند. تکنسین با افزودن یک آنزیم به پتری دیش و مشاهده واکنش خون و آنتی ژن، این موضوع را بررسی می کند.
در صورت تغییر رنگ محتویات ظرف ممکن است به این بیماری مبتلا باشید. میزان تغییر آنزیم به تکنسین اجازه می دهد تا حضور و مقدار آنتی بادی را تعیین کند.
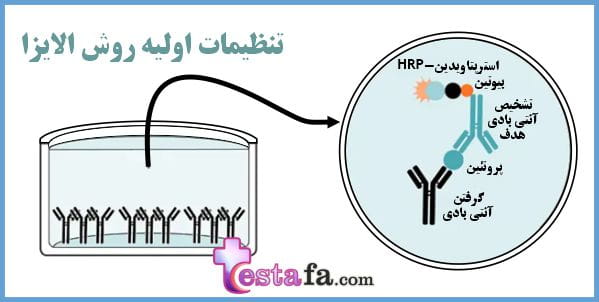
اصول اولیه الیزا
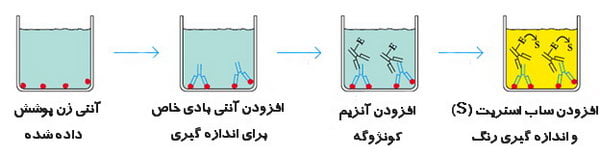
یک آنتی بادی به سطح پلاستیکی یک پلیت پلی وینیل یا پلی استایرن (که یک سطح جامد است) متصل است و جذب باکتری ها، سایر آنتی بادی ها و هورمون ها می شود. . به چنین سیستم هایی، سنجش ایمونوسوربنت فاز جامد (SPIA) نیز گفته می شود.
میکروتیتر (پلیت چند چاهک) پوشش داده شده با آنتی ژن (نمونه مورد نظر)، با مخلوط آنتی ژن-آنتی بادی پر می شود و پس از آن آنتی بادی های آزاد یا متصل نشده با شستشو حذف می شوند.
یک آنتی بادی دوم مخصوص آنتی بادی اولیه اضافه می شود که معمولاً با یک آنزیم، کونژوگه می شود.
سیستم آنزیمی شامل:
یک آنزیم: پراکسیداز ترب کوهی، آلکالین فسفاتاز که به یک آنتی بادی خاص نشان داده شده یا مرتبط است.
یک سوبسترا خاص:
-o فنیلن دی آمین دی هیدروکلراید برای پراکسیداز
P نیتروفنیل فسفات (PNPP) – برای آلکالین فسفاتاز
آنتی بادی های ثانویه متصل به آنزیم آزاد با شستن پلیت حذف می شوند.
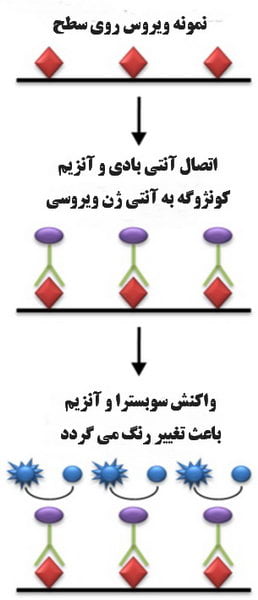
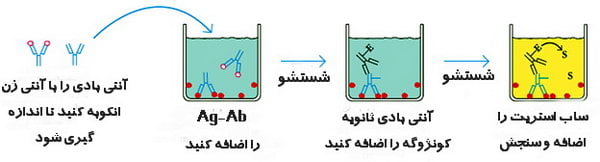
در نهایت، سوبسترا اضافه می شود. سوبسترا توسط آنزیم، کاتالیز (معمولا هیدرولیز میکند) و تبدیل به یک محصول رنگی (یک ترکیب زرد در مورد آلکالین فسفاتاز) ، که یک سیگنال قابل مشاهده است می شود که می تواند با اسپکتروفتومتری (الایزا ریدر) اندازه گیری شود. شدت رنگ متناسب با مقدار آنتی بادی یا آنتی ژن موجود در نمونه آزمایشی است.
پروتئین HCG که نشان دهنده بارداری است با روش های الایزا تشخیص داده می شود. ترکیبی از نمونه خون یا ادرار و HCG خالص شده مرتبط با یک آنزیم به سیستم اضافه می شود. اگر HCG در نمونه آزمایشی وجود نداشته باشد، تنها آنزیم متصل به سطح جامد متصل می شود.
هر چه ماده مورد نظر بیشتر باشد، واکنش بیشتری صورت می گیرد و آنزیم کمتری به سطح جامد متصل می شود. این واکنش ها معمولاً با تغییر رنگ محلول نشان داده می شوند.
تفسیر نتایج تست الایزا:
نحوه گزارش نتایج آزمایش Elisa بر اساس آزمایشگاهی که آنالیز را انجام می دهد متفاوت است. همچنین بستگی به شرایطی دارد که برای آن آزمایش می شوید. پزشک باید نتایج و معنای آنها را مورد بحث و تفسیر قرار دهد. گاهی اوقات، یک نتیجه مثبت به این معنی است که شما این شرایط را ندارید.
مثبت کاذب و منفی کاذب ممکن است رخ دهد. یک نتیجه مثبت کاذب نشان می دهد که شما مبتلا به بیماری هستید در حالی که واقعاً مبتلا نمی باشید. یک نتیجه منفی کاذب نشان می دهد که شما مبتلا به بیماری نیستید در حالی که واقعاً مبتلا می باشید.
به همین دلیل، ممکن است از شما خواسته شود تا چند هفته دیگر ELISA را تکرار کنید، یا ممکن است پزشک آزمایش های حساس تری را برای تایید یا رد نتایج تجویز کند.
صفحه خوان الایزا (میکروپلیت خوان یا سنجش خوان)
اسپکتروفتومتری که توسط خوانندگان ELISA انجام می شود، مقدار نور جذب شده و منعکس شده توسط یک نمونه مانند پروتئین را اندازه گیری می کند. فلورسانس و لومینسانس را می توان با صفحه خوان های ELISA نیز اندازه گیری کرد.
هنگامی که در معرض نور قرار می گیرند، رنگ های شیمیایی فلورسانس می شوند – یک رنگ یا طول موج خاصی را ساطع می کنند. یک ماده با کمیت بازتاب، جذب و رنگ شناسایی و اندازه گیری می شود.
اکثر خوانندگان ELISA همچنین دارای نرم افزاری هستند که اندازه گیری های شدت خام را با داده های رقت و خطا به منحنی های کمی تبدیل می کند. منحنیهای کالیبراسیون در نرمافزار گنجانده شدهاند تا تضمین کنند که ابزار با حداکثر پتانسیل خود استفاده میشود و در عین حال بالاترین سطح کیفیت و تکرارپذیری را حفظ میکند.
در روش های الایزا و برای استخراچ نتایج آزمایش Elisa نیاز به الایزا ریدر ضرورت دارد.
اساس صفحه خوان الایزا (ELISA Plate Reader)
عملکرد اولیه میکروپلیت خوان اندازه گیری اختلاف انرژی نور قبل و بعد از عبور از نمونه آزمایشی با استفاده از رنگ سنج فوتوالکتریک یا اسپکتروفتومتر است. تفاوت انرژی در نور ناشی از جذب ماده آزمایشی معمولاً به طور خطی با غلظت ماده آزمایش مرتبط است.
محدوده طول موج خوان میکروپلیت معمولاً ۴۰۰ تا ۷۵۰ نانومتر است و توسط فیلترها یا توری های پراش (نانو متر) محدود می شود. برخی از خوانندگان آنالیزهای خود را بین ۳۴۰ تا ۷۰۰ نانومتر در حالی که در طیف فرابنفش کار می کنند انجام می دهند. فیبرهای نوری در سیستم نوری برای تامین نور چاه های میکروپلیت حاوی نمونه استفاده می شود.
قطر پرتو نوری که از نمونه عبور می کند بین ۱ تا ۳ میلی متر است. نور ساطع شده از نمونه توسط یک دستگاه تشخیص شناسایی می شود که سیگنال را تقویت می کند و جذب نمونه را محاسبه می کند. از طریق یک سیستم خواندن به داده تبدیل می شود و امکان تفسیر نتایج آزمون را فراهم می کند. چندین میکروپلیت خوان از سیستم نور دو پرتو استفاده می کنند.
ابزار صفحه خوان الایزا
منبع نور
عموماً از لامپ های فلاش زنون به عنوان منبع نور استفاده می شود.
فیلترها و تک رنگ ها
این دو فناوری انتخاب طول موج رقیب هستند که در طراحی ریدر میکروپلیت جداییناپذیر هستند. تک رنگ ها نور چند رنگ را به نور تک رنگ تبدیل می کنند. مسیرهای نور برای تحریک و تشخیص شامل فیلترهای نوری با طول موج و پهنای باند خاص است. فیلترها در مقایسه با تک رنگ ارزانتر هستند. اینها بین منبع نور و نمونه قرار می گیرند.
میکروپلیت
میکروپلیت ها به گونه ای طراحی شده اند که دارای چاه هایی با حجم محدود برای نمونه گیری هستند. چاه های ۹۶، ۳۸۴ و ۱۵۳۶ در هر بشقاب محبوب ترین چاه ها برای غربالگری هستند.
میکروپلیت خوان
فنآوریهای مختلفی مانند جذب، فلورسانس و لومینسانس برای تشخیص و تعیین کمیت رویدادهای شیمیایی، بیولوژیکی یا فیزیکی در چاه یک میکروپلیت استفاده میشوند.
نرم افزار برای نتایج
نرم افزارهای مختلفی را می توان برای ساده سازی فرآیند تجزیه و تحلیل داده ها نصب و به کار گرفت.
مزایای استفاده از آنزیم ها:
مزایای استفاده از آنزیم ها در تست الایزا به عنوان برچسب دارای چندین مزیت است:
- خود آنزیم در طی الایزا تغییر نمی کند و می تواند واکنش بسیاری از مولکول های سوبسترا را کاتالیز کند، واکنش را تا حد زیادی تقویت کرده و تشخیص را افزایش می دهد.
- آنتی بادی های کونژوگه آنزیمی پایدار هستند و می توانند برای مدت نسبتا طولانی ذخیره شوند.
- تشکیل یک محصول نهایی رنگی امکان مشاهده مستقیم واکنش یا خواندن اسپکتروفتومتری خودکار را فراهم می کند.
ویژگی های بارز تست الایزا
- آزمایش Elisa به دلیل سادگی و حساسیت به طور فزاینده ای در تشخیص آنتی ژن (عامل عفونی) یا آنتی بادی استفاده می شود.
- این روش به اندازه رادیوامونواسی (RIA) حساس است و تنها به مقادیر میکرولیتری از معرف های آزمایشی نیاز دارد.
- در حال حاضر به طور گسترده ای در تشخیص انواع آنتی بادی ها و آنتی ژن ها مانند هورمون ها، سموم و ویروس ها استفاده می شود.
- تست الایزا حساسیت و ویژگی بالایی دارد.
- نتیجه آزمایشات کمی الایزا را می توان به صورت بصری خواند.
- تعداد زیادی آزمایش را می توان در یک زمان انجام داد.
- ELISA ها به طور خاص برای غربالگری تعداد زیادی از نمونه ها در یک زمان طراحی شده اند و آنها را برای استفاده در نظارت و خدمات انتقال خون متمرکز مناسب می کند.
- معرف های مورد استفاده برای ELISA پایدار هستند و می توانند در آزمایشگاه های منطقه و روستا توزیع شوند.
- از آنجایی که تست الایزا (آزمایش Elisa) برای انجام به تجهیزات پیچیده و تکنسین های ماهر نیاز دارد، استفاده از آنها به شرایط خاصی محدود می شود.
مزایا و معایب تست الایزا
مزایا:
- حساسیت و ویژگی بالا: تشخیص آنتی ژن ها در سطح پیکوگرام به روشی بسیار خاص به دلیل استفاده از آنتی بادی توسط آزمایش Elisa رایج است.
- توان عملیاتی بالا: کیت های تجاری ELISA معمولاً در قالب پلیت ۹۶ چاهک موجود هستند. اما این روش را می توان به راحتی با پلیت های ۳۸۴ چاهک تطبیق داد.
- اجرای آسان: پروتکل ها به راحتی قابل پیگیری هستند و زمان کمی را در بر می گیرند.
- کمی: می تواند غلظت آنتی ژن را در نمونه تعیین کند.
- امکان آزمایش انواع مختلف نمونه: سرم، پلاسما، عصاره های سلولی و بافتی، ادرار و بزاق و غیره.
معایب:
- بازخوانی های موقت: تشخیص بر اساس واکنش های آنزیم/سوبسترا است و بنابراین بازخوانی باید در یک بازه زمانی کوتاه به دست آید.
- اطلاعات آنتی ژن محدود: اطلاعات محدود به مقدار یا حضور آنتی ژن در نمونه.
مواد مورد نیاز در تست الایزا
- بخش اول: پیپت، سیستم واشر(شست و شو)، ELISA plate reader: ریدرها، واشرها و پیپت ها به صورت سیستم های دستی یا خودکار در دسترس هستند. یکی از عوامل اصلی موثر بر انتخاب تجهیزات، تعداد و نوع نمونه های آزمایشی است که اجرا می شوند.
- ریدرهای الایزا: ریدرها باید فیلتر مناسب (۶۵۰ نانومتر و ۴۵۰ نانومتر) داشته باشند.
- پیپت: این پیپت ها به صورت ولوم ثابت و قابل تنظیم و همچنین تک کاناله و چند کاناله موجود هستند.
- سیستم شستشو: می تواند یک سیستم دستی باشد که یک ردیف یا ستون را در یک زمان شستشو می دهد یا سیستم نیمه خودکاری که یک نوار یا پلیت را در یک زمان شستشو می دهد یا یک سیستم کاملاً خودکار که می تواند چندین پلیت را پردازش کند.
- بخش دوم: معرف های مورد نیاز برای آزمایش – موجود در کیت (پلیت های پوشش داده شده، رقیق کننده های نمونه، کنترل ها، کنسانتره شستشو، کنژوگه، سوبسترا، محلول توقف)
- پلیت پوشش داده شده: پلیت ۹۶ چاهک از پلی استایرن ساخته شده اند و با آنتی ژن یا آنتی بادی غیرفعال پوشیده شده اند. عملکرد پلیت باید آنتی ژن یا آنتی بادی بی حرکت را نگه دارد. آنتی ژن ها یا آنتی بادی های موجود در نمونه به پلیت متصل می شوند. این پوشش به عنوان محل اتصال آنتی بادی ها یا آنتی ژن ها در نمونه عمل می کند.
- کنترل ها: کنترل های منفی و مثبت در هر کیت ارائه شده است. کنترل ها به نرمال یا استاندارد کردن هر پلیت کمک می کنند. همچنین از کنترل ها برای اعتبارسنجی سنجش و محاسبه نتایج نمونه استفاده می شود. کنترل ها ممکن است از قبل رقیق شده و آماده استفاده باشند.
- کنژوگه ها: کونژوگه های ELISA آنتی بادی های نشاندار شده با آنزیم هستند که به طور خاص به آنالیت های نمونه متصل به پلیت واکنش نشان می دهند. کونژوگه های غیر متصل پس از انکوباسیون و قبل از افزودن سوبسترا شسته می شوند.
- کنسانتره شستشو: به عنوان یک محلول بافر حاوی مواد شوینده برای شستن مواد چسبانده نشده از پلیت عمل می کند. (همه کیت های تست دارای کنسانتره شستشو نیستند؛ در این صورت می توان از آب مقطر برای شستشو استفاده کرد؛ لطفاً برای دستورالعمل های خاص به درج کیت مراجعه کنید)
- محلول توقف: واکنش آنزیم- سوبسترا و توسعه رنگ را متوقف می کند.
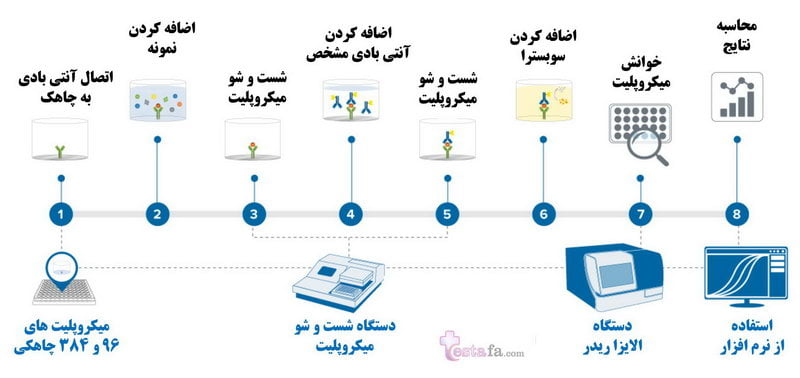
آزمایش Elisa معمولاً در یک پلیت چند چاهک (۹۶ یا ۳۸۴ چاهک) انجام می شود که سطح جامد را برای بی حرکت کردن آنتی ژن فراهم می کند. بی حرکتی آنالیت ها جداسازی آنتی ژن از بقیه اجزای نمونه را تسهیل می کند. این ویژگی ELISA را به یکی از آسانترین سنجشها برای انجام همزمان روی چندین نمونه تبدیل میکند.
روش های الایزا
روش های الایزا به چند روش طراحی و اجرا می گردد. به عنوان مثال، در حالی که یک سنجش ممکن است برای ارزیابی وجود یک آنتی ژن در یک نمونه استفاده شود، دیگری ممکن است برای تشخیص وجود یک آنتی بادی طراحی شود.
در حالت اول، از یک آنتی بادی مخصوص آنتی ژن برای پوشش سطح استفاده می شود و نمونه ای که احتمالاً حاوی آنتی ژن است اضافه می شود.
در حالت دوم، سطح با آنتی ژن پوشانده شده و نمونه مورد آزمایش برای وجود آنتی بادی اضافه می شود. در هر دو سناریو، سپس از یک آنتی بادی ثانویه مرتبط با آنزیم برای تشخیص تشکیل کمپلکس های آنتی ژن-آنتی بادی استفاده می شود.
روش سوم یک ELISA رقابتی است که در آن کمپلکس های آنتی ژن-آنتی بادی به چاهک های نشاندار شده با آنتی ژن اضافه می شود و به دنبال آن یک آنتی بادی ثانویه که مخصوص آنتی بادی اولیه استفاده شده است اضافه می شود.
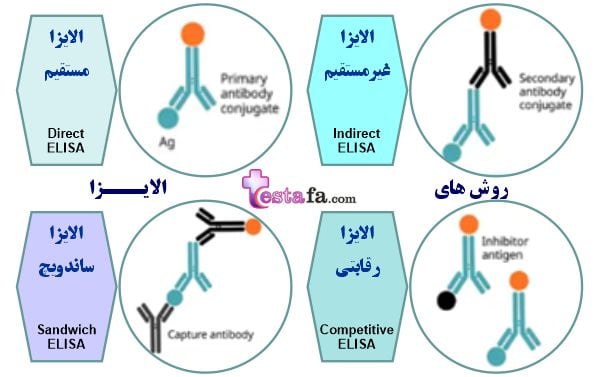
چهار نوع اصلی الایزا وجود دارد:
روش های الایزا به چهار روش تقسیم می گردد: الایزای مستقیم، الایزای غیرمستقیم، الایزای ساندویچی و الایزای رقابتی. هر کدام مزایا، معایب و مناسبت منحصر به فردی دارند.
الایزا مستقیم (Direct ELISA)
یکی از روش های الایزا، الایزا مستقیم نام دارد. این روش وجود آنتی ژن را در نمونه تشخیص می دهد. یک چاهک میکروتیتر ابتدا با یک آنتی بادی همولوگ مخصوص آنتی ژن مورد نظر پوشیده می شود. پس از آن چاهک را با یک عامل مسدود کننده پوشش می دهند تا از اتصال غیر اختصاصی اجزاء جلوگیری شود.
نمونه مورد سنجش به چاهک اضافه می شود. اگر آنتی ژن وجود داشته باشد، با آنتی بادی پوشش دهنده چاهک واکنش نشان می دهد. اگر هیچ کدام وجود نداشته باشد، هیچ واکنشی رخ نمی دهد.
در این شکل از ELISA، آنتی بادی متصل به آنزیم (کونژوگه) نیز برای آنتی ژن مورد نظر اختصاصی است. هنگامی که به چاهک اضافه می شود، در صورت وجود به آنتی ژن متصل می شود. پس از زمان دادن به آنتی بادی مرتبط با آنزیم برای واکنش با آنتی ژن، چاهک شسته می شود تا هرگونه آنتی بادی متصل به آنزیم (که با اضافه شدن سوبسترا مثبت کاذب ایجاد می کند) حذف شود.
پس از افزودن سوبسترا، تغییر رنگ شاهدی بر تبدیل آنزیمی سوبسترا به محصول آن است که نشان دهنده وجود آنتی ژن است.
الایزای غیر مستقیم (Indirect ELISA)
از دیگر روش های الایزا، تکنیک غیر مستقیم است که که از یک فرآیند دو مرحله ای برای تشخیص استفاده می کند، به موجب آن یک آنتی بادی اولیه مخصوص آنتی ژن به هدف متصل می شود و یک آنتی بادی ثانویه نشاندار شده علیه گونه میزبان آنتی بادی اولیه برای تشخیص به آنتی بادی اولیه متصل می شود. همانطور که برای سنجش مستقیم ELISA، آنتی ژن در سطح پلیت چند چاهکی بی حرکت می شود.
این روش همچنین می تواند برای شناسایی آنتی بادی های خاص در نمونه سرم با جایگزینی سرم به جای آنتی بادی اولیه استفاده شود.
ساندویچ الایزا (Sandwich ELISA)
یکی از روش های الایزا، تکنیکی به عنوان الایزای رقابتی است. ساندویچ الایزا (یا ایمونواسی ساندویچ) رایج ترین فرمت مورد استفاده است. این فرمت به دو آنتی بادی خاص برای اپی توپ های مختلف آنتی ژن نیاز دارد. این دو آنتی بادی معمولاً به عنوان جفت آنتی بادی منطبق شناخته می شوند.
یکی از آنتی بادی ها روی سطح پلیت چندچاهک پوشانده شده و به عنوان یک آنتی بادی جذب برای تسهیل بی حرکتی آنتی ژن استفاده می شود. آنتی بادی دیگر کونژوگه است و تشخیص آنتی ژن را تسهیل می کند.
روش ساندویچ الایزا مرسوم ترین شیوه بین روش های الایزا محسوب می گردد. تصویر زیر یک گردش کار برای یک روش ELISA ساندویچ معمولی را نشان می دهد:
الایزای رقابتی (Competitive ELISA)
همچنین به عنوان ELISA مهاری یا ایمونواسی رقابتی شناخته می شود، سنجش های ELISA رقابتی غلظت یک آنتی ژن را با تشخیص تداخل سیگنال اندازه گیری می کنند. هر یک از قالب های قبلی را می توان با قالب رقابتی تطبیق داد.
آنتی ژن نمونه برای اتصال به مقدار خاصی از آنتی بادی نشاندار شده با آنتی ژن مرجع رقابت می کند. آنتی ژن مرجع از قبل روی یک پلیت چندچاهک پوشانده شده و نمونه با آنتی بادی نشاندار شده از قبل انکوبه شده و به چاهکک ها اضافه می شود.
بسته به مقدار آنتی ژن در نمونه، آنتی بادی های کم و بیش آزاد برای اتصال آنتی ژن مرجع در دسترس خواهند بود. این بدان معنی است که هر چه آنتی ژن در نمونه بیشتر باشد، آنتی ژن مرجع کمتری شناسایی می شود و سیگنال ضعیف تر می شود.
برخی از کیت های رقابتی ELISA از آنتی ژن نشاندار به جای آنتی بادی نشاندار استفاده می کنند. آنتی ژن نشاندار شده و آنتی ژن نمونه (بدون برچسب) برای اتصال به آنتی بادی اولیه با هم رقابت می کنند. هرچه مقدار آنتی ژن در نمونه کمتر باشد، به دلیل آنتی ژن نشاندار بیشتر در چاهک، سیگنال قوی تر می شود.
مقایسه انواع روش های الیزا
روش آزمایش الیزا | مزایا | معایب |
الایزا مستقیم (Direct ELISA) | پروتکل کوتاه: باعث صرفه جویی در زمان و معرف ها می شود. عدم واکنش متقابل از آنتی بادی ثانویه. | زمینه بالقوه بالا: تمام پروتئین های نمونه به سطح متصل می شوند. بدون تقویت سیگنال انعطاف پذیری کم: آنتی بادی اولیه باید کونژوگه شود. |
الایزای غیر مستقیم (Indirect ELISA) | تقویت سیگنال: چندین آنتی بادی ثانویه به آنتی بادی اولیه متصل می شوند. انعطاف پذیری بالا: همان آنتی بادی ثانویه ممکن است برای چندین آنتی بادی اولیه استفاده شود. | پروتکل طولانی اگر با الایزا مستقیم مقایسه شود. واکنش متقابل بالقوه از آنتی بادی ثانویه |
ساندویچ الایزا (Sandwich ELISA) | اختصاصیت بالا: شامل دو آنتی بادی است که اپی توپ های مختلف را روی یک آنتی ژن یکسان تشخیص می دهند. مناسب برای نمونه های پیچیده انعطاف و حساسیت بالا: می توان از هر دو روش مستقیم و غیر مستقیم استفاده کرد. | طراحی سخت: یافتن دو آنتی بادی علیه یک هدف که اپی توپ های مختلف را تشخیص می دهند و به خوبی با هم کار می کنند، گاهی اوقات می تواند چالش برانگیز باشد. |
الایزای رقابتی (Competitive ELISA) | بستگی به ELISA پایه انتخاب شده دارد. برای آنتی ژن های کوچک مناسب است. | بستگی به ELISA پایه انتخاب شده دارد |
جدول۱: روش های الایزا – تست الایزا (آزمایش Elisa)
طبقه بندی داده های الایزا
سنجش الایزا را می توان با توجه به نوع داده های به دست آمده به صورت زیر طبقه بندی کرد:
- الایزا کیفی فقط تعیین می کند که آیا آنتی ژن در نمونه وجود دارد یا نه. به یک چاهکک خالی بدون آنتی ژن یا یک آنتی ژن کنترل نامربوط نیاز دارد.
- ELISA نیمه کمی امکان مقایسه نسبی سطوح آنتی ژن بین نمونه ها را فراهم می کند.
- ELISA کمی امکان محاسبه مقدار آنتی ژن موجود در نمونه را فراهم می کند که نیاز به مقایسه مقادیر اندازهگیری شده برای نمونهها با یک منحنی استاندارد تهیهشده از رقتسازی سریالی یک آنتیژن خالصشده در غلظت مشخصی دارد که شایع ترین داده های ELISA گزارش شده است.
منحنی استاندارد ELISA
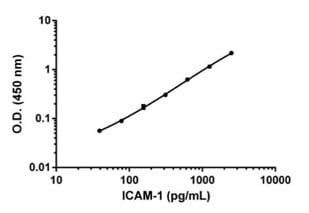
منحنی استاندارد یا کالیبراسیون عنصری از ELISA کمی است که امکان محاسبه غلظت آنتی ژن در نمونه را فراهم می کند.
منحنی استاندارد از رسم غلظت های شناخته شده آنتی ژن مرجع در برابر بازخوانی به دست آمده برای هر غلظت (معمولاً چگالی نوری در ۴۵۰ نانومتر) به دست می آید.
اکثر ELISA ریدرها یک نرم افزار برای ایجاد منحنی و تجزیه و تحلیل داده ها دارند. غلظت آنتی ژن در نمونه با برون یابی قسمت خطی منحنی استاندارد محاسبه می شود.
نمونه ای از منحنی استاندارد الایزا کمی
تست الایزا (آزمایش Elisa) معمولاً در یک پلیت چند چاهک (۹۶ یا ۳۸۴ چاهک) انجام می شود که سطح جامد را برای بی حرکت کردن آنتی ژن فراهم می کند. بی حرکتی آنالیت ها جداسازی آنتی ژن از بقیه اجزای نمونه را تسهیل می کند. این ویژگی ELISA را به یکی از آسانترین سنجشها برای انجام همزمان روی چندین نمونه تبدیل میکند.
انتخاب کیت ELISA مناسب برای نمونه مورد نظر
ارزیابی دقیق عملکرد آزمایش اولین گام مهم در انتخاب کیت ELISA جدید است. پارامترهای مهم شامل حساسیت، محدوده دینامیکی و دقت است که برای اکثر کیت های ELISA گزارش شده است. سایر پارامترها عملکرد ELISA را برای انواع نمونه معمولی پیش بینی می کنند. درصد بازیابی و خطی بودن رقت، پروتئین هدف را در نمونه های واقعی مانند پلاسما، سرم یا محیط کشت سلولی اندازه گیری می کند.
این راهنمای کوتاه نحوه تفسیر پارامترهای مختلف را توضیح میدهد تا به شما کمک کند کیت ELISA مناسب را برای نمونه خود پیدا کنید.
خلاصه پارامترهایی که باید هنگام انتخاب کیت الایزا به دنبال آنها باشید:
پارامتر | ملاک پذیرش |
حساسیت | *به پروتئین هدف بستگی دارد |
محدوده دینامیکی | *به پروتئین هدف بستگی دارد |
CV (%) برای دقت intra-assay | ≤ ۱۰% |
CV (%) برای دقت inter-assay | ≤ ۱۵% |
اختصاصیت | واکنش پذیری را با پروتئین های بسیار همولوگ مورد بررسی قرار دهید |
% بازیابی | %۸۰≥ |
خطی بودن رقت | ≤ ۱۵% تفاوت با نمونه های رقیق نشده |
جدول۲: پارامترهای انتخاب کیت الایزا – تست الایزا (آزمایش Elisa)
نکته مهم
برای بررسی مناسب بودن حساسیت و محدوده دینامیکی یک ELISA مشخص، مهم است که بدانیم چه سطحی از پروتئین مورد نظر در یک نمونه مورد انتظار است. نمونه هایی با غلظت بالایی از پروتئین هدف را می توان رقیق کرد تا سیگنال خام در محدوده دینامیکی مورد سنجش قرار گیرد.
حساسیت
حساسیت پایین ترین سطح پروتئینی است که جفت آنتی بادی مورد استفاده در کیت الایزا می تواند به دقت تشخیص دهد.
محدوده دینامیکی
محدوده دینامیکی به عنوان غلظت های بالا و پایین پروتئین هدف تعریف می شود که سنجش می تواند به دقت کمیت کند.
مقادیر گزارش شده برای حساسیت و محدوده دینامیکی می تواند گمراه کننده باشد زیرا اغلب با استفاده از پروتئین استاندارد در بافرهای ساده تعیین می شود که ممکن است نشان دهنده سینتیک تشخیص یک پروتئین درون زا در یک نمونه بیولوژیکی نباشد.
CV
CV (%) یا ضریب تنوع نشان می دهد که میزان سازگاری سنجش چقدر است.
CV به طور کلی برای ارزیابی ثبات بین دقت inter-assay یا plate to plate و دقت intra-assay یا سازگاری بین تکرارهای اجرا شده در همان آزمایش محاسبه میشود.
CVهای کمتر از ۱۵ درصد inter-assay عموماً قابل قبول هستند.
درصد CVهای intra-assay باید کمتر از ۱۰ باشد.
اختصاصیت
مهم است که آنتی بادی های مورد استفاده در کیت ELISA با پروتئین های غیر هدف واکنش متقابل نداشته باشند. اینها می توانند پروتئین هایی با همسانی بالا در بین گونه ها باشند.
درصد بازیابی
درصد (%) بازیابی با متصل کردن مقدار مشخصی از پروتئین هدف خالص شده در یک نوع نمونه بیولوژیکی (همچنین به نام ماتریس نمونه) تعیین میشود. برای پروتئین های ترشح شده مانند سیتوکین ها، ماتریس های نمونه معمولی پلاسما و سرم هستند. برای پروتئین های داخل سلولی مانند کینازها، نمونه ها لیزات کشت سلولی هستند.
نمونه متصل شده در الایزا اندازه گیری می شود و غلظت آن از منحنی استاندارد محاسبه می شود. این غلظت محاسبه شده با غلظت شناخته شده پروتئین مقایسه می شود و به صورت درصد بیان می شود. به عنوان مثال، بازیابی ۱۰۰٪ به این معنی است که غلظت مشاهده شده با غلظت واقعی پروتئین مشخص شده در نمونه یکسان بود. این نشان میدهد که پروتئینها و سایر مولکولها در نوع نمونه در تعیین کمیت پروتئین تداخلی نداشتهاند.
اگر درصد بازیابی کمتر از ۸۰ درصد برای یک نوع نمونه خاص باشد، باید یک کیت ELISA متفاوت برای تعیین کمیت انتخاب شود.
خطی بودن رقت
خطی بودن رقت همراه خوبی برای درصد بازیابی است، زیرا پروتئین اصلی را در نمونه های بیولوژیکی اندازه گیری می کند. خطی بودن رقت با اندازه گیری رقت های متعدد نمونه های مثبت شناخته شده توسط الایزا تعیین می شود. غلظت پروتئین هدف با ضرب ضریب رقت در غلظت محاسبه شده تعیین می شود. برای بهترین نتایج، غلظت نمونه ها باید برای همه رقت ها مشابه باشد. اگر اختلاف بیش از ۲۰ درصد از نمونه رقیق نشده مشاهده شد، باید یک کیت ELISA متفاوت برای تعیین کمیت دقیق انتخاب شود.
آماده سازی نمونه الایزا
این موارد دستورالعمل های کلی برای آماده سازی نمونه های آزمایش شده معمول برای استفاده در تست الایزا (آزمایش Elisa) هستند. مانند تمام جنبه های توسعه سنجش، روش های بهینه آماده سازی نمونه بسته به هدف و سنجش مورد علاقه متفاوت خواهد بود.
روش های آماده سازی نمونه
مایع رویی کشت سلولی
محیط کشت سلولی را در لوله سانتریفیوژ پیپت کرده و با سرعت ۱۵۰۰ دور در دقیقه به مدت ۱۰ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید.
بلافاصله از مایع رویی جدا کرده و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
عصاره سلولی
پلیت کشت بافت را روی یخ قرار دهید.
محیط را آسپیره کنید و سلولها را یکبار با PBS سرد یخ بشویید.
PBS را آسپیره کنید و ۰.۵ میلی لیتر بافر استخراج کامل را در هر پلیت ۱۰۰ میلی متری اضافه کنید.
سلول ها را خراش دهید تا در پلیت کج شده جمع آوری شوند و در لوله از قبل سرد شده خارج شوند.
برای مدت کوتاهی به صورت دورانی بچرخانید و به مدت ۱۵-۳۰ دقیقه روی یخ قرار دهید.
با دور ۱۳۰۰۰ به مدت ۱۰ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید تا محتویات نامحلول ته نشین شوند.
مقدار کمی مایع رویی (این عصاره سلولی محلول است) را به درون لوله های تمیز و سرد بریزید. نمونه ها در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
محیط شرطی شده
سلول ها را در محیط رشد کامل (حاوی سرم) قرار دهید و اجازه دهید سلول ها تا سطح تلاقی مطلوب تکثیر شوند.
محیط رشد را بردارید و به آرامی با چند میلی لیتر PBS گرم بشویید. مرحله شستشو را تکرار کنید.
آخرین شستشوی PBS را بردارید و به آرامی محیط رشد بدون سرم را اضافه کنید.
۱-۲ روز انکوبه کنید.
محیط را داخل لوله سانتریفیوژ بریزید و با سرعت ۱۵۰۰ دور در دقیقه به مدت ۱۰ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید.
بلافاصله مایع رویی را جدا کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
شیر
نمونه ها را جمع آوری کنید و در ۱۰۰۰۰ x g به مدت ۲ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید.
مایع رویی را به مقدار کافی استفاده کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
پلاسما
خون کامل را در لوله های حاوی ضد انعقاد جمع آوری کنید، و ۰.۱مولار سدیم را به حجم نهایی۱۰/۱ اضافه کنید.
با سرعت ۳۰۰۰ دور در دقیقه به مدت ۱۰ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید.
بلافاصله مایع رویی (پلاسما) را به مقدار کافی تقسیم کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
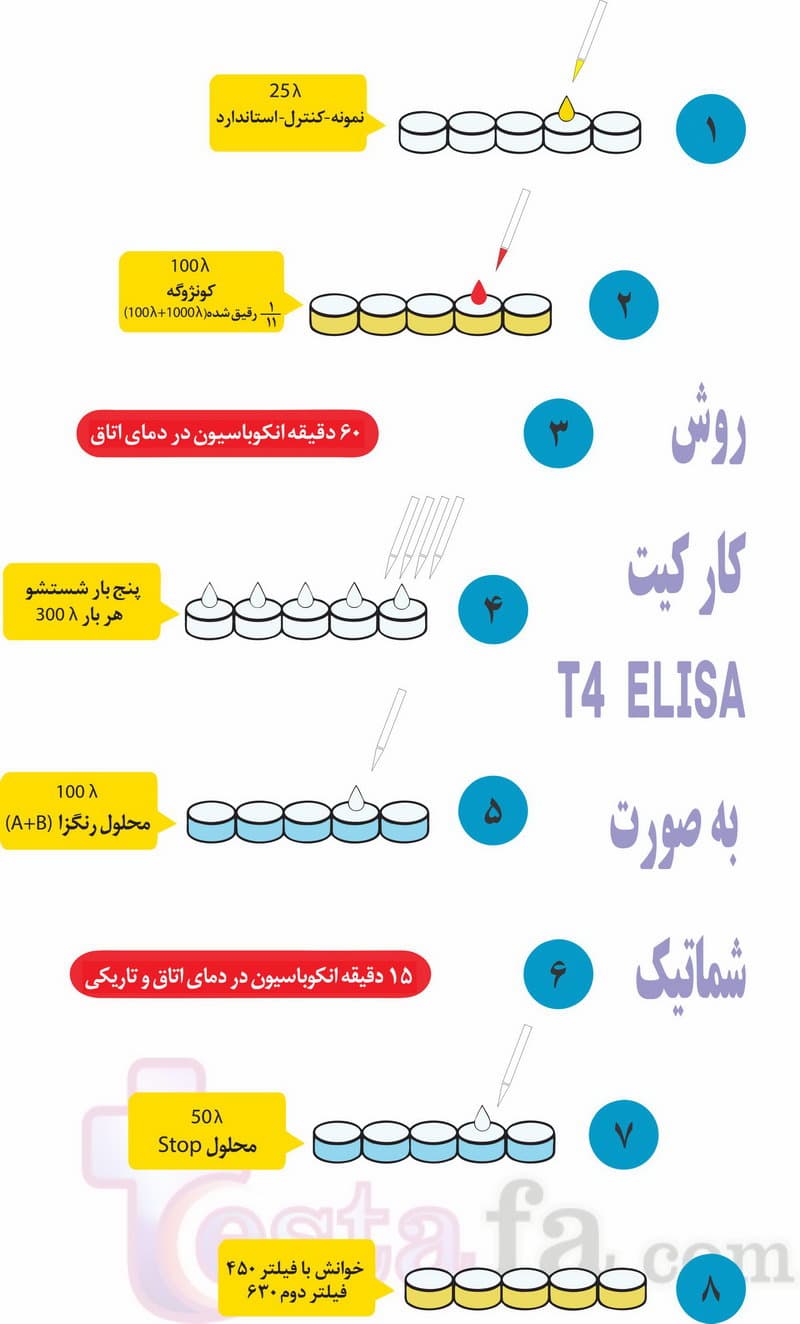
در تصویر زیر به عنوان نمونه، روش استفاده از کیت الایزا (تیروکسین) مشاهده می گردد:
ادرار
نمونه ها را جمع آوری کنید و در ۱۰۰۰۰ x g به مدت ۲ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید.
مایع رویی را به مقدار کافی استفاده کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
بزاق
نمونه ها را جمع آوری کنید و در ۱۰۰۰۰ x g به مدت ۲ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید.
مایع رویی را به مقدار کافی استفاده کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
سرم
خون کامل را در لوله آزمایش ، به عنوان مثال، یک لوله بدون ضد انعقاد جمع آوری کنید.
بدون مزاحمت در دمای اتاق به مدت ۲۰ دقیقه انکوباسیون کنید.
با سرعت ۳۰۰۰ دور در دقیقه به مدت ۱۰ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید.
بلافاصله مایع رویی (سرم) را به مقدار کافی تقسیم کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
عصاره بافت
بافت مورد نظر را با ابزار تمیز، ترجیحاً روی یخ و در اسرع وقت تشریح کنید تا از تخریب توسط پروتئازها جلوگیری شود.
دستمال را در لوله های میکروفیوژ ته گرد قرار دهید و در نیتروژن مایع غوطه ور کنید تا به سرعت یخ بزند. نمونه ها را برای استفاده بعدی در دمای ۸۰- درجه سانتیگراد نگهداری کنید یا برای همگن شدن فوری روی یخ نگه دارید.
برای یک قطعه ۵ میلی گرمی از بافت، ۳۰۰ میکرولیتر بافر استخراج کامل به لوله اضافه کنید و با هموژنایزر الکتریکی همگن کنید.
تیغه را دو بار با استفاده از بافر استخراج کامل ۳۰۰ میکرولیتری برای هر شستشو بشویید، سپس به مدت ۲ ساعت در دمای ۴ درجه سانتیگراد هم زدن را ثابت نگه دارید (مثلاً روی شیکر اوربیتال در اتاق سرد قرار دهید).
به مدت ۲۰ دقیقه در ۱۳۰۰۰ دور در دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید. روی یخ، مقدار کمی مایع رویی (این عصاره پروتئین محلول است) را در یک لوله تازه و خنک قرار دهید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
نمونه کنترل های مورد نیاز برای روش های الیزا
کنترلهای مناسب به شما کمک میکند تا نتایج مثبت واقعی را از نتایج نادرست تست الایزا (آزمایش Elisa) تفکیک نمایید. اگر زمانی نیاز به عیب یابی پروتکل خود داشته باشید، کنترل های مثبت و منفی نیز مفید خواهند بود.
کنترل مثبت
از یک نمونه محلول درون زا (endogenous) که حاوی پروتئینی است که شما شناسایی می کنید یا از یک پروتئین یا پپتید خالص شده که حاوی توالی ایمونوژن برای آنتی بادی مورد استفاده شما است استفاده کنید. یک نتیجه مثبت از کنترل مثبت، حتی اگر نمونه ها منفی باشند، نشان دهنده بهینه سازی و کارکرد درست روش است و بررسی می کند که هر گونه نتیجه منفی بدست آمده معتبر است.
توصیه میشود برگه اطلاعات آنتی بادی را مطالعه کنید. اغلب یک کنترل مثبت پیشنهادی را ارائه می دهد. اگر کنترلی پیشنهاد نمی شود، موارد زیر را توصیه می کنیم:
هر بافت، سلول یا لیزاتی که با موفقیت مورد استفاده قرار گرفته باشد می تواند یک کنترل مثبت مناسب در نظر گرفته شود.
سعی کنید به پیوندهای پایگاه داده Swiss-Prot یا Omnigene در دیتاشیت نگاه کنید. این پایگاههای داده اغلب دارای فهرستی از بافتهایی هستند که پروتئین در آنها بیان میشود. اینها همچنین میتوانند کنترلهای مثبت مناسبی در نظر گرفته شوند.
ورودی GeneCards را برای پروتئین بررسی کنید. زیرا معمولاً سطوح نسبی بیان را در بافت های مختلف برای شما فراهم می کند.
اگر هنوز در یافتن یک کنترل مناسب مشکل دارید، توصیه می کنیم یک جستجوی سریع در PubMed انجام دهید تا ببینید کدام بافت ها و سلول ها پروتئین مورد نظر را بیان می کنند.
کنترل منفی
کنترل منفی نمونه ای است که می دانید پروتئینی را که شما تشخیص می دهید بیان نمی کند. کنترل منفی به منظور بررسی اتصالات غیر اختصاصی و مثبت کاذب است. هر پلیتی که استفاده می کنید باید حاوی یک نمونه کنترل منفی باشد تا نتایج را تایید کند.
استاندارد
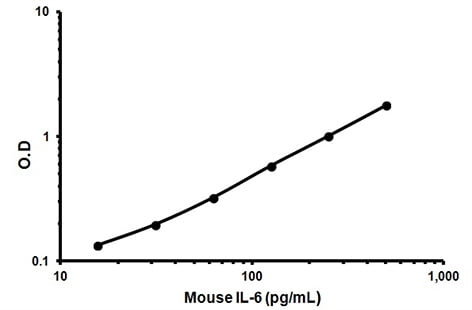
نمونه ای است که حاوی غلظت مشخصی از پروتئین هدف است که منحنی استاندارد را می توان از آن به دست آورد. به عنوان مثال، در زیر یک منحنی استاندارد معمولی از کیت الایزا IL6 موشی با غلظت ۱۵.۶ تا ۵۰۰ میکروگرم در میلی لیتر آورده شده است. منحنی استاندارد ضعیف به این معنی است که آنتی بادی به درستی متصل نشده یا استاندارد پروتئین را نمی گیرد. مقدار R2 خط روند باید > 0.99 باشد.
استاندارد در کنترل ماتریس نمونه (کنترل اسپایک)
هنگام (آزمایش Elisa) نمونه های سرم در الایزا، طبق معمول یک استاندارد در بافر رقیق کننده معمولی قرار دهید. اما توصیه می کنیم یک استاندارد رقیق شده در سرم گونه ای که در حال آزمایش هستید نیز اضافه کنید. سپس می توان این دو را با هم مقایسه کرد تا اطمینان حاصل شود که هیچ تأثیری بر منحنی استاندارد سایر پروتئین های سرم وجود ندارد که به عنوان کنترل اسپایک شناخته می شود و به شما می گوید که یک پروتئین هدف پس از قرار گرفتن در ماتریس قابل بازیابی است. نتایج قابل قبول ۸۰-۱۲۰٪ است.
کنترل مثبت درون زا (Endogenous)
اگر در حال (آزمایش Elisa) یک نمونه پروتئین نوترکیب هستید، توصیه میکنیم که یک کنترل مثبت درون زا اضافه کنید که باید جزء ضروری آزمایش شما باشد.
مشکلات طبیعی با تشخیص آنتی بادی پروتئین های نوترکیب وجود دارد که باید در نظر گرفته شود. تا شدن پروتئین نوترکیب ممکن است با شکل بومی درون زا متفاوت باشد و ممکن است از دسترسی آنتی بادی به اپی توپ جلوگیری کند به ویژه در مورد پروتئین های برچسب گذاری شده نیز صادق است. همیشه از قرار دادن برچسب ها در انتهای N یا C ترمینال پروتئین نوترکیب اطمینان حاصل کنید.
مهمتر از همه، همیشه مطمئن شوید که پروتئین نوترکیب شامل توالی ایمونوژن آنتی بادی است که استفاده می کنید. یک کنترل مثبت درون زا برای تأیید نتایج مهم است، و همچنین نشان می دهد که واکنشگرها (مثلاً آنتی بادی ها) و روش چقدر خوب کار می کنند.
جدیدترین کیت های الایزا که در سایت تستا معرفی شده است.
-
 کیت سنجش TSH (192 تستی) الایزا
۲,۲۶۰,۰۰۰ تومان
کیت سنجش TSH (192 تستی) الایزا
۲,۲۶۰,۰۰۰ تومان
-
 کیت سنجش TSH (96 تستی) الایزا
۱,۲۵۶,۰۰۰ تومان
کیت سنجش TSH (96 تستی) الایزا
۱,۲۵۶,۰۰۰ تومان
-
 کیت سنجش هورمون T4 (192 تستی) الایزا
۲,۱۵۵,۰۰۰ تومان
کیت سنجش هورمون T4 (192 تستی) الایزا
۲,۱۵۵,۰۰۰ تومان
-
 کیت سنجش هورمون T4 (96 تستی) الایزا
۱,۱۹۷,۰۰۰ تومان
کیت سنجش هورمون T4 (96 تستی) الایزا
۱,۱۹۷,۰۰۰ تومان
-
 کیت سنجش هورمون T3 (192 تستی) الایزا
۱,۹۲۵,۰۰۰ تومان
کیت سنجش هورمون T3 (192 تستی) الایزا
۱,۹۲۵,۰۰۰ تومان
-
 کیت سنجش هورمون T3 (96 تستی) الایزا
۱,۰۷۰,۰۰۰ تومان
کیت سنجش هورمون T3 (96 تستی) الایزا
۱,۰۷۰,۰۰۰ تومان
-
 کیت رنگ آمیزی تری کروم ( ماسون ) | آسیا پژوهش
۹۳۷,۵۰۰ تومان
کیت رنگ آمیزی تری کروم ( ماسون ) | آسیا پژوهش
۹۳۷,۵۰۰ تومان
- https://www.immunology.org/public-information/bitesized-immunology/experimental-techniques/enzyme-linked-immunosorbent-assay
- https://www.abcam.com
- Chernecky CC, et al. (2012). Laboratory tests and diagnostic procedures (6th ed.). St. Louis, Missouri: Saunders Elsevier.
- Laboratory methods: enzyme-linked immunosorbent assay (ELISA). (2017).
labtestsonline.org/understanding/features/methods/start/2/ - Understanding the EIA test. (2015).
cdc.gov/lyme/diagnosistesting/LabTest/TwoStep/EIA/index.html - WHO guidelines on drawing blood: best practices in phlebotomy (n.d.).
who.int/injection_safety/job_aids/en - Yalow, Rosalyn S.; Berson, Solomon A. (1960). "Immunoassay of endogenous plasma insulin in man". The Journal of Clinical Investigation. ۳۹ (۷): ۱۱۵۷–۷۵. doi:10.1172/JCI104130. PMC ۴۴۱۸۶۰. PMID ۱۳۸۴۶۳۶۴.
- ^ Lequin, R. M. (2005). "Enzyme Immunoassay (EIA)/Enzyme-Linked Immunosorbent Assay (ELISA)". Clinical Chemistry. ۵۱ (۱۲): ۲۴۱۵–۸. doi:10.1373/clinchem.2005.051532. PMID ۱۶۱۷۹۴۲۴.
- ^ Wide, Leif; Porath, Jerker (1966). "Radioimmunoassay of proteins with the use of Sephadex-coupled antibodies". Biochimica et Biophysica Acta (BBA) - General Subjects. ۱۳۰ (۱): ۲۵۷–۶۰. doi:10.1016/0304-4165(66)90032-8.
- ^ Engvall, Eva; Perlmann, Peter (1971). "Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G". Immunochemistry. ۸ (۹): ۸۷۱–۴. doi:10.1016/0019-2791(71)90454-X. PMID ۵۱۳۵۶۲۳.
- ^ Van Weemen, B.K.; Schuurs, A.H.W.M. (1971). "Immunoassay using antigen—enzyme conjugates". FEBS Letters. ۱۵ (۳): ۲۳۲–۲۳۶. doi:10.1016/0014-5793(71)80319-8. PMID ۱۱۹۴۵۸۵۳. S2CID ۳۷۱۴۷۷۲۳.
- ^ Leng, S. X.; McElhaney, J. E.; Walston, J. D.; Xie, D.; Fedarko, N. S.; Kuchel, G. A. (2008). "ELISA and Multiplex Technologies for Cytokine Measurement in Inflammation and Aging Research". The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. ۶۳ (۸): ۸۷۹–۸۴. doi:10.1093/gerona/63.8.879. PMC ۲۵۶۲۸۶۹. PMID ۱۸۷۷۲۴۷۸.
- ^ Adler, Michael; Schulz, Sven; Spengler, Mark (2009). "Cytokine Quantification in Drug Development: A comparison of sensitive immunoassay platforms". Chimera Biotech.
- http://cepclab.org.in/?p=436
- https://www.sepmag.eu/blog/elisa-reader









عالی👏👏👏